浅谈细胞治疗行业的监管体系
2024-01-10

引言���:
近日���,国家发展和改革委员会发布《产业结构调整指导目录(2024年本)》���,自2024年2月1日起施行。其中在鼓励类的医药板块下���,多个领域涉及细胞基因产业发展���,包括鼓励大规模高效细胞培养和纯化���,基因治疗和细胞治疗药物���,化学成分限定细胞培养基���,高端化���、智能化制药设备等。
在上述背景下���,笔者根据过往经办项目经验���,对细胞治疗行业的监管体系进行简析���,以供探讨。
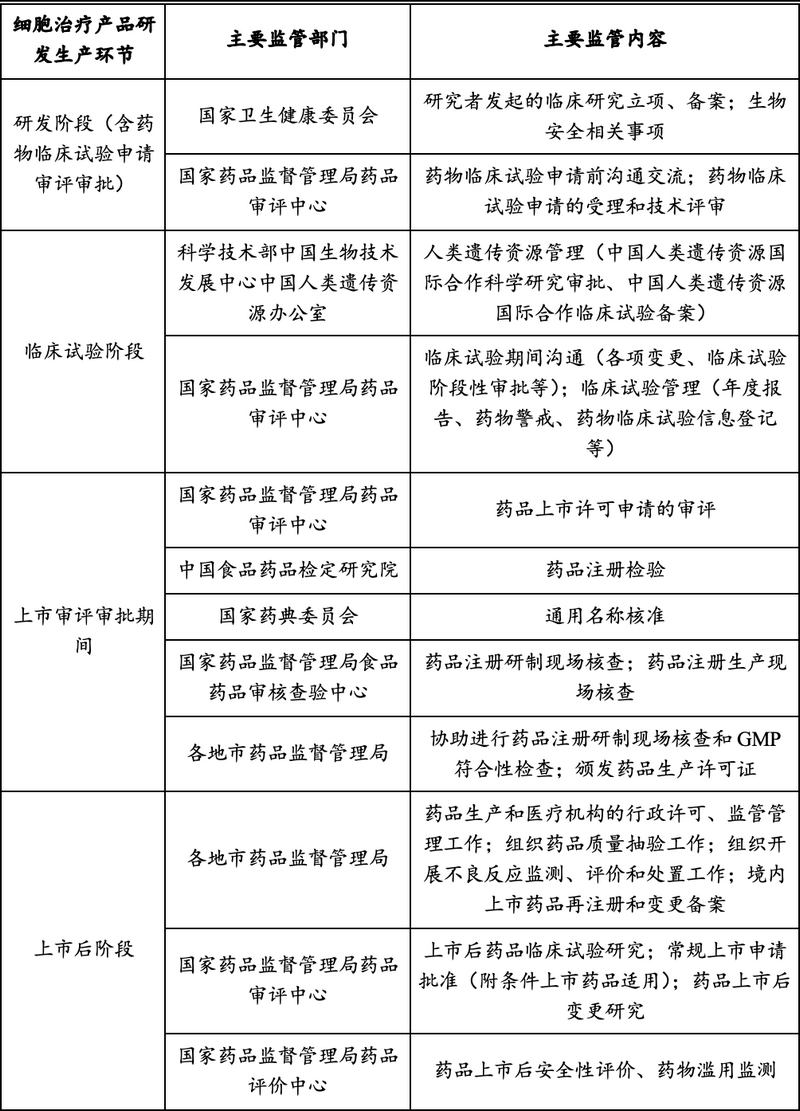
一���、细胞治疗产品研发生产各环节的主要监管部门
细胞治疗行业的研发生产各环节的主要监管部门���、主要监管内容具体如下���:
二���、细胞治疗产品研发生产各环节的主要监管要求
细胞治疗产品的产品类型���、作用机制���、体内作用和代谢特点与传统小分子或生物大分子药物有显著区别���,技术迭代和升级迅速���,除适用《药品管理法》《药品注册管理办法》等相关法律法规对于药品的一般监管要求外���,还需适用《细胞治疗产品研究与评价技术指导原则(试行)》等特定监管规定。
1.在药品研发和申报方面
首先���,根据《药品注册管理办法》第二十五条规定���,开展药物临床试验���,应当经伦理委员会审查同意。因此相关企业在就相关免疫细胞治疗产品开展临床试验前���,需依法提交医疗机构的伦理委员会审查并取得相关批准。
其次���,根据《药品注册管理办法》第二十三条规定���,申请人完成支持药物临床试验的药学���、药理毒理学等研究后���,提出药物临床试验申请的���,应当按照申报资料要求提交相关研究资料。经形式审查���,申报资料符合要求的���,予以受理。药品审评中心应当组织药学���、医学和其他技术人员对已受理的药物临床试验申请进行审评。对药物临床试验申请应当自受理之日起六十日内决定是否同意开展���,并通过药品审评中心网站通知申请人审批结果;逾期未通知的���,视为同意���,申请人可以按照提交的方案开展药物临床试验。也即相关企业在完成支持药物临床试验的药学���、药理毒理学等研究后���,应依法提出药物临床试验申请。
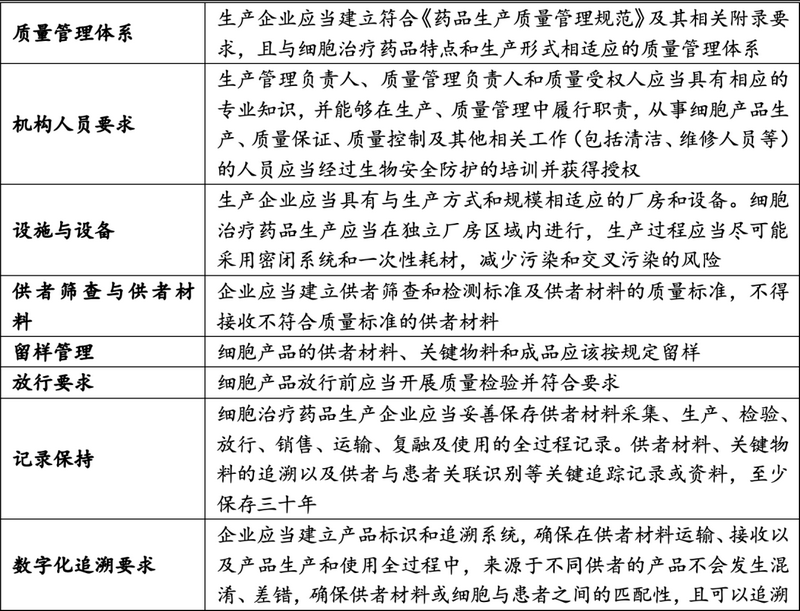
2.在生产过程方面
相关企业临床试验用药的制备需符合《药品生产质量管理规范》《细胞治疗产品生产质量管理指南(试行)》等规定���,具体如下���:
3.生物安全性方面
根据《生物安全法》第四十二条的规定���,国家加强对病原微生物实验室生物安全的管理���,制定统一的实验室生物安全标准。病原微生物实验室应当符合生物安全国家标准和要求。从事病原微生物实验活动���,应当严格遵守有关国家标准和实验室技术规范���、操作规程���,采取安全防范措施。
因此相关企业应就其开展相关药品生产活动所需的实验室到国家卫生健康委员会等相关部门履行备案手续。
4.人类遗传资源方面
根据《人类遗传资源管理条例》第二十二条规定���,为获得相关药品和医疗器械在我国上市许可���,在临床机构利用我国人类遗传资源开展国际合作临床试验���、不涉及人类遗传资源材料出境的���,不需要审批。但是���,合作双方在开展临床试验前应当将拟使用的人类遗传资源种类���、数量及其用途向国务院科学技术行政部门备案。
因此���,相关企业如开展国际合作相关临床试验的���,应及时履行相应的审批或备案手续。
三���、外商投资领域限制
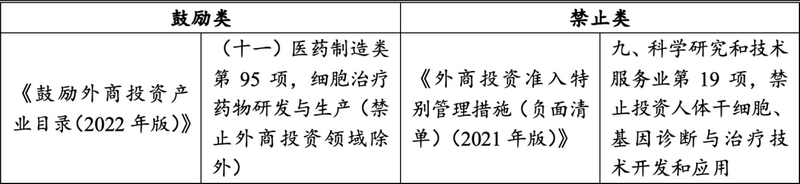
可见���,鼓励类侧重于药品监管方面���,将“医药制造业”中的“细胞治疗药物研发与生产”纳入鼓励类目录;限制类侧重于医疗技术监管方面���,将“科学研究和技术服务业”中的“基因诊断与治疗技术开发和应用”纳入禁止类。
根据公开信息检索���,已上市企业对于所从事的细胞免疫治疗业务是否属于中国法律法规项下禁止外商投资领域存在差异化陈述���:
(1)传奇生物(代码���:LEG.N)在其招股文件中披露认为《负面清单》所述“基因诊断与治疗技术开发和应用”的释义范围不明确���,其下属子公司南京传奇生物科技有限公司正在研发的CAR-T细胞疗法不属于“人体干细胞”的范畴或“基因诊断和治疗技术”。
(2)永泰生物(代码���:HK.6978)���、药明巨诺(代码���:HK.2126)及科济药业(代码���:HK.2171)在其招股文件中披露认为CAR-T产品相关业务适用《负面清单》并搭建VIE结构。
同时���,经检索已有部分外商投资企业取得了免疫细胞疗法的新药批准证书���,具体如下表所示���:
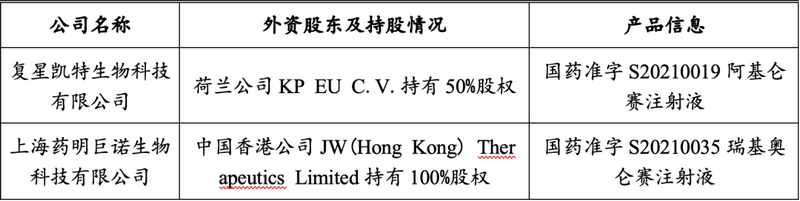
综上���,目前针对免疫细胞治疗相关业务是否属于外商限制投资领域���,在实际操作认定上还存在一定的差异���,但伴随着行业监管体系的完善���,我国药监局实际批准了中外合资或外商独资药厂从事CAR-T药物研究���、注册���,也标志着按照药物申报的免疫细胞治疗产品行业在国内的准入政策更加包容。
本文作者���:

指导合伙人���:

声明���:
本文由k8凯发天生赢家·一触即发律师事务所律师原创���,仅代表作者本人观点���,不得视为k8凯发天生赢家·一触即发律师事务所或其律师出具的正式法律意见或建议。如需转载或引用本文的任何内容���,请注明出处。
